








Категория: Инструкции

На фармакологический рынок планирует выйти новая разработка корпорации Eli Lilly. Ее задача – «победить» сахарный диабет II типа. Международное название препарата – Trulicity (Трулисити).
Медицинские специалисты рекомендуют вводить лекарство подкожно всего 1 раз в 7 дней – по их мнению, данной дозы вполне достаточно для пациентов, которые стараются вести активный образ жизни и тщательно соблюдают требования диетологов. Трулисити осуществляет контроль глюкозы в крови пациентов, страдающих этим недугом.
В клиническом исследовании, которое прошло успешно, участвовали где-то 3200 добровольцев. В результате медики доказали не только эффективность, но и безопасность препарата Трулисити. Исследователи комбинировали терапию в комплексе с другими популярными медикаментами (прандиальным инсулином, метформином, тиазолидиндионом) и одиночно.
В медицинских опытах на мышах препарат Дулаглутид (Трулисити) показал довольно серьезный негативный побочный эффект – повышение риска заболевания раком щитовидной железы. но в испытаниях на добровольцах аналогичные случаи не были зафиксированы. Но все равно, эксперты, контролирующие нахождение на рынке медикаментозных средств, порекомендовали компании-разработчику провести дополнительные исследования для сведения к минимуму всевозможных негативных рисков.
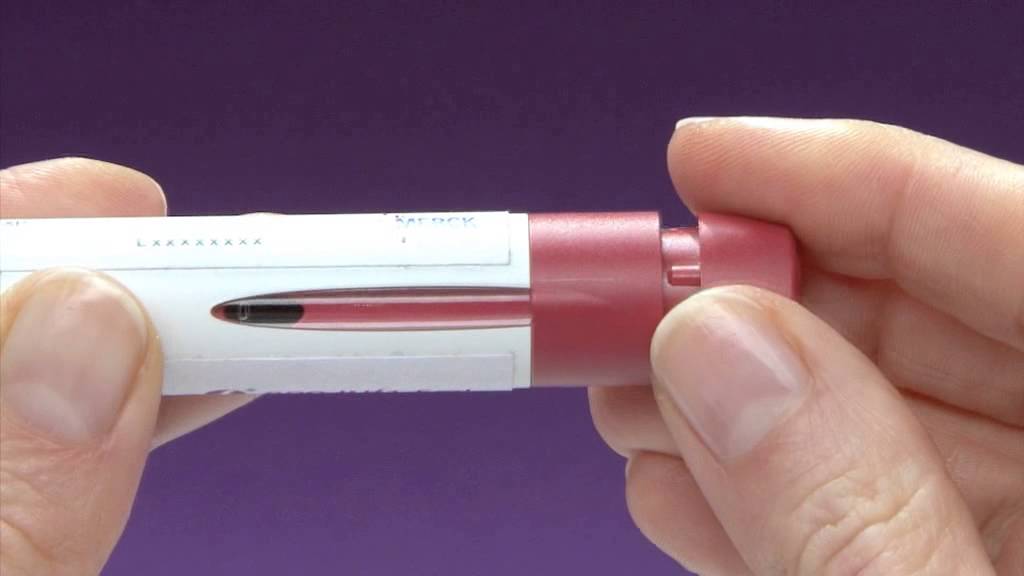
Препарат Трулисити (дулаглютид) представляет собой раствор для инъекций, помещенный в шприц-ручку со спрятанной иглой. Активное вещество является агонистом рецептора глюкагоноподобного пептида-1.
Рекомендовано его использование в дозировке 1,5 мг один раз в неделю для пациентов, принимающих Трулисити в комбинации с другими противодиабетическими препаратами, и в дозировке 0,75 мг один раз в день при применении препарата в качестве монотерапии, или как начальная дозировка при комбинированной терапии у особо уязвимых групп пациентов, в том числе и в возрасте 75 лет и старше.
Основой для одобрения препарата Трулисити (дулаглютид) стали результаты шести крупномасштабных клинических исследований III фазы. В ходе пяти из них лекарственное средство, принимаемое пациентами в дозировке 1,5 мг, продемонстрировало большую эффективность в снижении средних показателей гликированного гемоглобина, чем четыре наиболее распространенные противодиабетические препараты и плацебо. Прием пациентами препарата Трулицити в дозировке 0,75 мг позволил достичь сходного снижения показателей гликированного гемоглобина в одном испытании и лучшего в остальных четырех. В шестом исследовании назначение лекарственного средства Трулицити в дозировке 1,5 мг позволило добиться похожего снижения гликированного гемоглобина в сравнении с наивысшей одобренной дозой часто назначаемого агониста рецептора глюкагоноподобного пептида-1 с применением один раз в день. Трулисити (Дулаглютид) 1,5 мг/4 шт
Показания к применению:
Препарат Трулисити™ показан у взрослых пациентов с сахарным диабетом 2 типа для улучшения гликемического контроля в монотерапии и комбинированной терапии
с другими гипогликемическими препаратами, включая инсулин, если данные препараты вместе с диетой и физическими упражнениями не обеспечивают необходимого гликемического контроля.
Дулаглутид представляет собой аГПП-1 длительного действия, полученный в результате соединения двух молекул аналога ГПП-1 человека и изменённого Fc-фрагмента иммуноглобулина G (IgG4) человека. Особенности строения молекулы дулаглутида обеспечивают его низкую иммуногенность, стабильность в растворенной форме и период полувыведения продолжительностью 4,7 дней, благодаря чему препарат подходит для подкожного введения 1 раз в неделю. В большинстве из закончившихся исследований дулаглутид 1.5 мг в неделю показал превосходство снижении HbA1c над препаратами сравнения: метформином, ситаглиптином, эксенатидом для введения 2 раза в день, и инсулином гларгин, и не меньшую эффективность при сравнении с лираглутидом 1.8 мг 1 раз в день, при сопоставимом или меньшем риске гипогликемический реакций. Также терапия дулагултидом в дозировке 1.5 мг приводила к достоверному стойкому снижению массы тела.
Инновационными свойствами препарата дулаглутид являются режим дозирования 1 раз в неделю, а также средство введения — готовая к применению шприц-ручка. Ее особенности: простота в использовании, отсутствие необходимости ресуспензировать препарат, предварительно прикрепленная и скрытая и от глаз пациента игла, при инъекции пациент не вводит иглу в кожу, а нажимает кнопку, а также минимальная болезненность при инъекции и наличие сигнала, подтверждающего введение дозы препарата.

Администрация пищевых продуктов и лекарственных средств США (FDA) на днях разрешила применять новый препарат Trulicity для лечения сахарного диабета 2 типа.
Trulicity (дулаглютид) – это инъекционный противодиабетический препарат, который достаточно вводить всего 1 раз в неделю.
Препарат предназначен для взрослых пациентов.
«Trulicity – это новая опция лечения, которую можно назначать самостоятельно или в дополнение к другим схемам лечения для контроля уровня сахара в крови при диабете 2 типа», - пишет доктор Мэри Паркс (Mary Parks), директор отделения по оценке лекарств II FDA в новостном релизе агентства.
Сегодня приблизительно 26 миллионов жителей США страдают сахарным диабетом 2 типа. Более 90% случаев диабета приходится на второй тип, и только 10% составляет сахарный диабет 1 типа, так называемый инсулинозависимый. Сахарный диабет 2 типа сопровождается повышением уровня сахара в крови, что приводит к повреждению почек, сердечно-сосудистым заболеваниям, поражению глаз, нервов и др.
Препарат Trulicity (активное вещество – дулаглютид) относится к группе агонистов рецепторов глюкагоноподобного пептида-1 (GLP-1).
Перед принятием решения FDA проанализировала результаты шести клинических испытаний, которые в общей сложности включали 3 500 пациентов с сахарным диабетом 2 типа. Препарат Trulicity изучали отдельно и в комбинации с другими препаратами, включая метформин, инъекционный инсулин и др.
По словам представителей агентства, пациенты, которым еженедельно делали инъекции Trulicity, могли значительно лучше контролировать сахар в крови в долговременной перспективе. Наиболее частыми побочными эффектами дулаглютида были тошнота и рвота, боль в животе и пониженный аппетит.
В инструкции Trulicity будет содержаться предупреждение о том, что использование некоторых агонистов рецепторов GLP-1 в экспериментах на грызунах ассоциировалось с повышенным риском опухолей щитовидной железы. Эксперты FDA говорят, что Trulicity не должен назначаться пациентам, у которых ранее была медуллярная карцинома щитовидной железы или имеются упоминания о ней в семейном анамнезе. Также препарат нельзя назначать пациентам с синдромом множественной эндокринной неоплазии 2 типа (МЭН 2): при этом заболевании опухоли возникают более чем в одной железе организма, в том числе повышается риск медуллярной карциномы щитовидной железы.
Новый препарат, который производится фармацевтической компанией Eli Lilly, не предназначен для использования у пациентов с сахарным диабетом 1 типа, у людей с тяжелыми заболеваниями желудочно-кишечного тракта. Также Trulicity не является препаратом первого ряда, поэтому его будут рекомендовать больным, для которых другие препараты и режимы лечения оказались неэффективными.
В новостном релизе говорится, что в FDA потребовали от производителя Trulicity провести несколько дополнительных постмаркетинговых исследований для оценки сердечно-сосудистых эффектов препарата и безопасности применения у лиц с высоким сердечно-сосудистым риском.
Поделитесь с друзьями








Я не уверен(а), что шприц-ручка сработала правильно.
Проверьте, получили ли вы нужную дозу. Доза введена правильно, если виден серый поршень (см. шаг 3 ). Также свяжитесь с компанией Lilly по тел. +7(727) 2447 447 или со своим лечащим врачом, чтобы получить дальнейшие указания. До тех пор храните шприц-ручку с осторожностью, во избежание случайного укола.
Побочные действияПобочные реакции, встречавшиеся чаще, чем в единичных случаях, перечислены в соответствии со следующей градацией: очень часто (≥10%), часто (≥1%, <10%), иногда (≥0,1%, <1%), редко (≥0,01%, < 0,1%), крайне редко (<0,01%).
Побочные реакции, наблюдавшиеся в ходе клинических исследований*
Так как клинические исследования проводятся при широко варьирующих условиях, невозможно непосредственно сравнивать частоту нежелательных реакций, наблюдаемых в клинических исследованиях лекарственного препарата, с частотой, наблюдаемой в кинических исследованиях другого лекарственного препарата, и она может не отражать частоту, наблюдаемую в клинической практике.
подтвержденная симптоматическая гипогликемия (при совместном применении с препаратами сульфонилмочевины, прандиальынм инсулином)
диареяа (увеличение объема кала, усиление перистальтики)
рвотаb (включая позывы на рвоту, рвоту фонтаном)
боль в животеc (включая дискомфорт в животе, боль в нижних отделах живота, боль в верхних отделах живота, болезненность при пальпации живота, гастроинтестинальная боль)
тяжелая гипогликемия(при совместном применении с препаратами сульфонилмочевины, прандиальным инсулином)
увеличение уровня амилазы и липазы
риск развития С-клеточных опухолей щитовидной железы
Сводные данные плацебо-контролируемых исследований
Нежелательные реакции со стороны желудочно-кишечного тракта
В совокупности плацебо-контролируемых исследований нежелательные реакции со стороны желудочно-кишечного тракта более часто встречались у пациентов, получавших Трулисити™ по сравнению с плацебо (плацебо 21,3; 0,75 мг – 31,6%; 1,5 мг – 41,0%). Большее количество пациентов, получавших Трулисити™ 0,75 мг (1,3%) и Трулисити™ 1,5 мг (3,5%), прекратили лечение вследствие нежелательных реакций со стороны желудочно-кишечного тракта по сравнению с пациентами, получавшими плацебо (0,2%). Исследователи классифицировали тяжесть нежелательных явлений со стороны желудочно-кишечного тракта, возникающих при применении Трулисити™ 0,75 мг и 1,5 мг, как «легкую» в 58% и 48% случаев соответственно, «умеренную» - в 35% и 42% случаев соответственно и «тяжелую» - в 7% и 11% случаев соответственно.
Гипогликемия чаще наблюдалась при применении Трулисити™ в сочетании с сульфонилмочевиной или инсулином. Подтвержденная гипогликемия имела место у 39% и 40% пациентов, получавших Трулисити™ 0,75 мг и 1,5 мг, соответственно и сульфонилмочевину. Тяжелая гипогликемия имела место у 0% и 0,7% пациентов, получавших Трулисити™ 0,75 мг и 1,5 мг, соответственно и сульфонилмочевину. Подтвержденная гипогликемия имела место у 85% и 80% пациентов, получавших Трулисити™ 0,75 мг и 1,5 мг, соответственно и прандиальный инсулин. Тяжелая гипогликемия имела место у 2,4% и 3,4% пациентов, получавших Трулисити™ 0,75 мг и 1,5 мг, соответственно и прандиальный инсулин.
Трулисити™ 0,75 мг и 1,5 мг вызывал среднее увеличение частоты сердечных сокращений (ЧСС) на 2-4 удара в минуту. Долгосрочные клинические эффекты увеличения ЧСС не установлены
Синусовая тахикардия регистрировалась у 3,0%, 2,8% и 5,6% пациентов, получавших плацебо, Трулисити™ 0,75 мг и Трулисити™ 1,5 мг соответственно. Стойкая синусовая тахикардия (зарегистрированная при более 2-х визитах) зарегистрирована у 0,2%, 0,4% и 1,6% пациентов, получавших плацебо, Трулисити™ 0,75 мг и Трулисити™ 1,5 мг соответственно. Эпизоды синусовой тахикардии, связанные с сопутствующим увеличением частоты сердечных сокращений на ≥ 15 ударов в минуту по сравнению с исходным показателем, сообщались у 0,7%, 1,3% и 2,2% пациентов, получавших плацебо, Трулисити™ 0,75 мг и Трулисити™ 1,5 мг соответственно.
В четырех клинических исследований II фазы и пяти клинических исследований III фазы у 64 (1,6%) пациентов, получавших Трулисити™, появились противолекарственные антитела к активному ингредиенту Трулисити™ (например, дулаглутиду).
Из 64 пациентов, получавших дулаглутид, у которых появились антитела к дулаглутиду у 34 пациентов (0,9% общей популяции) были дулаглутид-нейтрализующие антитела, а у 36 пациентов (0,9% общей популяции) появились антитела к нативному GLP-1.
Определение антителообразования сильно зависит от чувствительности и специфичности анализа. Кроме того, на наблюдаемую частоту положительных результатов тестов на антитела (включая нейтрализующие антитела) могут влиять несколько факторов, включая методику анализа, обработку образца, время забора образца, сопутствующие лекарственные препараты и основное заболевание. По этим причинам невозможно непосредственно сравнить частоту случаев появления антител к дулаглутиду с частотой случаев появления антител к другим препаратам.
Нежелательные системные реакции гиперчувствительности, иногда тяжелой степени, (например, тяжелая крапивница, системная сыпь, отек лица, отек губ) встречались у 0,5% пациентов, получавших Трулисити™ в четырех клинических исследований II фазы и пяти клинических исследований III фазы.
Удлинение интервалаPRи нежелательные реакции, связанные с атриовентрикулярной (АВ) блокадойIстепени
Среднее увеличение интервала PR на 2-3 миллисекунды по сравнению с исходным уровнем наблюдалось у пациентов, получавших Трулисити™ в отличие от увеличения на 0,9 миллисекунд у пациентов, получавших плацебо. Нежелательная реакция, связанная с АВ-блокадой I степени чаще встречалась у пациентов, получавших Трулисити™, чем плацебо, (0,9%, 1,7% и 2,3% для плацебо, Трулисити™ 0,75 мг и Трулисити™ 1,5 мг соответственно). На электрокардиограммах увеличение интервала PR минимум до 220 миллисекунд наблюдалось у 0,7%, 2,5% и 3,2% пациентов, получавших плацебо, Трулисити™ 0,75 мг и Трулисити™ 1,5 мг соответственно.
Увеличение уровня амилазы и липазы
У пациентов, получавших Трулисити™, имело место среднее увеличение уровня липазы и/или панкреатической амилазы от исходного показателя на 14% - 20%, тогда как у пациентов, получавших плацебо, среднее увеличение составляло до 3%.
Противопоказаниямедуллярный рак щитовидной железы в личном или семейном анамнезе; пациенты с синдромом множественных эндокринных неоплазий 2 типа
гиперчувствительность к дулаглутиду или любому из вспомогательных компонентов
беременность и период лактации
детский и подростковый возраст до 18 лет
Лекарственные взаимодействияДулаглутид замедляет опорожнение желудка, что может нарушить всасывание совместно вводимых пероральных препаратов. Необходимо соблюдать осторожность при совместном введении пероральных лекарственных препаратов и Трулисити™. Следует адекватно контролировать уровни пероральных лекарственных препаратов с узким терапевтическим индексом при совместном введении Трулисити™. В клинических исследованиях Трулисити™ не влияет на всасываемость исследуемых пероральных лекарственных препаратов до клинически значимой степени.
Особые указанияВ 52-недельном двойном слепом исследовании (26-недельная первичная конечная точка) 807 пациентов не достигших компенсации с помощью диеты и физических упражнений или диеты и физических упражнений и одного перорального сахароснижающего препарата в субмаксимальной дозе были рандомизированы для получения Трулисити™ 0,75 мг один раз в неделю, Трулисити™ 1,5 мг один раз в неделю или метформина в дозе 1500 – 2000 мг/сутки через две недели периода вымывания. Семьдесят пять процентов (75%) рандомизированной популяции получали один препарат на скрининговом визите. Большинство пациентов, ранее получавших лечение пероральными сахароснижающими препаратами, получали метформин (
90%) в средней дозе 1000 мг в сутки и около 10% получали сульфонилмочевину.
Средний возраст пациентов составлял 56 лет, а продолжительность заболевания сахарным диабетом II типа – 3 года. Сорок четыре процента пациентов были мужчинами. Результатом лечения препаратом Трулисити™ в дозе 0,75 мг и 1,5 мг один раз в неделю было снижение уровня HbA1c от исходного уровня на 26-недельной первичной временной точке. Различие в наблюдаемой величине эффекта между Трулисити™ в дозе 0,75 мг и 1,5 мг соответственно и метформином исключало предусмотренный предел не меньшей эффективности 0,4%.
Дополнение к метформину
В данном 104-недельном плацебо-контролируемом, двойном слепом исследовании (52-недельная первичная конечная точка) 972 пациента были рандомизированы для получения плацебо, Трулисити™ 0,75 мг один раз в неделю, Трулисити™ 1,5 мг один раз в неделю или ситаглиптина в дозе 100 мг/сутки (через 26 недель пациенты в лечебной группе плацебо получали слепой ситаглиптин 100 мг/сутки в течение оставшегося исследования), все в качестве дополнения к метформину. Рандомизация имела место после 11-недельного вводного периода для предоставления периода титрования метформина, за которым следовал 6-недельный период гликемической стабилизации. Средний возраст пациентов составлял 54 года; средняя продолжительность заболевания сахарным диабетом II типа составляла 7 лет; 48% мужчин.
На 26 неделе плацебо-контролируемой временной точки изменение уровня HbA1 составляло 0,1%, -1,0%, -1,2% и -0,6% для плацебо, Трулисити™ 0,75 мг, Трулисити™ 1,5 мг и ситаглиптина соответственно. Процент пациентов, достигших HbA1< 7,0%, составлял 22%, 56%, 39% для плацебо, Трулисити™ 0,75 мг, Трулисити™ 1,5 мг и ситаглиптина соответственно. На 26 неделе среднее снижение массы тела составляло 1,4 кг, 2,7 кг, 3,0 кг и 1,4 кг для плацебо, Трулисити™ 0,75 мг, Трулисити™ 1,5 мг и ситаглиптина соответственно. Среднее снижение уровня глюкозы натощак составляло 9 мг/дл, 35 мг/дл, 41 мг/дл и 18 мг/дл для плацебо, Трулисити™ 0,75 мг, Трулисити™ 1,5 мг и ситаглиптина соответственно.
Результатом лечения препаратом Трулисити™ в дозе 0,75 мг и 1,5 мг один раз в неделю было статистически значимое снижение уровня HbA1c по сравнению с плацебо (на 26 неделе) и по сравнению с ситаглиптином (на 26 и 52 неделях), все в сочетании с метформином.
Дополнение к метформину и тиазолидиндиону
В данном 52-недельном плацебо-контролируемом, двойном слепом исследовании (26-недельная первичная конечная точка) 976 пациентов были рандомизированы для получения плацебо, Трулисити™ 0,75 мг один раз в неделю, Трулисити™ 1,5 мг один раз в неделю или эксенатида в дозе 10 мкг 2 раза в сутки, все в качестве дополнения к максимальным переносимым дозам метформина (≥1500 мг в сутки) и пиоглитазона (до 45 мг в сутки). Распределение в лечебную группу, получавшую эксенатид, было открытым, тогда как распределение в лечебные группы, получавшие плацебо, Трулисити™ 0,75 мг, Трулисити™ 1,5 мг, было слепым. Через 26 недель пациенты в лечебной группе плацебо были рандомизированы в группу, получавшую Трулисити™ 0,75 мг один раз в неделю или Трулисити™ 1,5 мг один раз в неделю для созранния маскированности исследования. Рандомизация имела место после 12-недельного вводного периода; в течение первых 4 недель вводного периода пациентов титровали до максимальных переносимых доз метформина и пиоглитазона; после этого следовал 8-недельный период гликемической стабилизации перед рандомизацией. У пациентов, рандомизированных для получения эксенатида, лечение начинали с дозы 5 мкг 2 раза в сутки в течение 4 недель, а затем увеличивали дозу до 10 мкг 2 раза в сутки. Средний возраст пациентов составлял 56 лет; средняя продолжительность заболевания сахарным диабетом II типа составляла 9 лет; 58% были мужчины.
Результатом лечения препаратом Трулисити™ в дозе 0,75 мг и 1,5 мг один раз в неделю было статистически значимое снижение уровня HbA1c по сравнению с плацебо (на 26 неделе) и по сравнению с эксенатидом на 26 неделе. В течение 52-недельного периода исследования процент пациентов, получавших резервную гликемическую терапию, составлял 8,9% в лечебной группе, получавшей Трулисити™ 0,75 мг один раз в неделю + метформин и пиоглитазон, 3,2% в лечебной группе, получавшей Трулисити™ 1,5 мг один раз в неделю + метформин и пиоглитазон, и 8,7% в лечебной группе, получавшей эксенатид 2 раза в сутки + метформин и пиоглитазон.
Дополнение к метформину и сульфонилмочевине
В данном 78-недельном (52-недельная первичная конечная точка) открытом сравнительном исследовании (двойное слепое относительно распределения в группу для получения Трулисити™) 807 пациентов были рандомизированы для получения Трулисити™ 0,75 мг один раз в неделю, Трулисити™ 1,5 мг один раз в неделю или инсулина гларгина один раз в сутки, все в качестве дополнения к максимальным переносимым дозам метформина и глимепирида. Рандомизация имела место после 10-недельного вводного периода; в течение первых 2 недель вводного периода пациентов титровали до максимальных переносимых доз метформина и глимепирида. Затем следовал 6- и 8-недельный период гликемической стабилизации перед рандомизацией.
У пациентов, рандомизированных для получения инсулина гларгина, лечение начинали с дозы 10 Ед. один раз в сутки. Коррекция дозы инсулина гларгина проводилась два раза в неделю в течение первых 4 недель лечения на основании самостоятельно определенного уровня глюкозы в плазме натощак, после чего титрование проводилось один раз в сутки в течение 8 недели исследуемого лечения, используя алгоритм, который нацелен на уровень глюкозы в плазме натощак < 100 мг/дл. Только 24% пациентов достигли цели в 52-недельную первичную конечную точку. Доза глимепирида могла быть снижена или отменена после рандомизации (по усмотрению исследования) в случае стойкой гипогликемии. Доза глимепирида снижалась или отменялась у 28%, 32% и 29% пациентов, рандомизированных для получения Трулисити™ 0,75 мг, Трулисити™ 1,5 мг и инсулина гларгина.
Средний возраст пациентов составлял 57 лет; средняя продолжительность заболевания сахарным диабетом II типа составляла 9 лет; 51% были мужчины.
Результатом лечения препаратом Трулисити™ один раз в неделю было снижение уровня HbA1c от исходного на 52 неделе при применении в сочетании с метформином и сульфонилмочевиной. Различие в величине эффекта между Трулисити™ 0,75 мг и 1,5 мг соответственно и гларгином в данном исследовании исключало предусмотренный предел не меньшей эффективности 0,4%.
Дополнение к прандиальному инсулину с или без метформина
В данном 52-недельном (26-недельная первичная конечная точка) открытом сравнительном исследовании (двойное слепое относительно распределения в группу для получения Трулисити™) 884 пациентов, получавших 1 или 2 инъекции инсулина в сутки, были включены в исследование. Рандомизация имела место после 9-недельного вводного периода; в течение первых 2 недель вводного периода пациенты продолжали доисследовательский режим введения инсулина, но мог быть начат и/или увеличена доза метформина по усмотрению исследователя; после этого следовал 7-недельный период гликемической стабилизации перед рандомизацией.
При рандомизации пациенты прекращали свой доисследовательский режим введения инсулина и были рандомизированы для получения Трулисити™ 0,75 мг один раз в неделю, Трулисити™ 1,5 мг один раз в неделю и инсулина гларгина один раз в сутки, все в сочетании с прандиальным инсулином лизпро 3 раза в сутки, с или без метформина. Инсулин лизпро титровался в каждой группе на основании предпрандиального уровня глюкозы и уровня глюкоза перед сном, а инсулина гларгин титровался до целевого уровня глюкозы в плазме натощак < 100 мг/дл. Только 36% пациентов достигли целевого уровня глюкозы в плазме натощак в 26-недельную первичную конечную точку.
Средний возраст пациентов составлял 59 лет; средняя продолжительность заболевания сахарным диабетом II типа составляла 13 лет; 54% были мужчины.
Результатом лечения препаратом Трулисити™ один раз в неделю было снижение уровня HbA1c от исходного. Различие в величине эффекта между Трулисити™ 0,75 мг и 1,5 мг соответственно и гларгином в данном исследовании исключало предусмотренный предел не меньшей эффективности 0,4%.
С-клеточные опухоли щитовидной железы. Трулисити™ противопоказан пациентам с медуллярным раком щитовидной железы в личном или семейном анамнезе или пациентам с МЭН-синдромом. Необходимо проконсультировать пациентов относительно потенциального риска развития медуллярного рака щитовидной железы при применении Трулисити™ и информировать их о симптомах опухолей щитовидной железы (например, опухолевидное образование в области шеи, дисфагия, одышка, стойкая дисфония). Рутинный мониторинг уровня кальцитонина в сыворотке или ультразвуковое исследование щитовидной железы не имеет определенного значения для раннего выявления медуллярного рака щитовидной железы у пациентов, получающих Трулисити™. Такой мониторинг может увеличить риск проведения ненужных процедур вследствие низкого тестирования специфичности кальцитонина сыворотки и высокой фоновой частоты заболеваний щитовидной железы. Повышение уровня кальцитонина (более 50 нг/л) в сыворотке может указывать на медуллярный рак щитовидной железы. Если кальцитонин в сыворотке определялся и обнаружено его повышение, пациента следует направить к эндокринологу для дальнейшего обследования. При повышенном содержании кальцитонина в сыворотке, необходимо дальнейшее обследование пациента. Пациентов, у которых обнаружены узлы в щитовидной железе необходимо направить для дальнейшего обследования.
Панкреатит. Немедленно прекратить прием при подозрении на панкреатит. Не возобновлять лечение при подтверждении панкреатита. У пациентов с панкреатитом в анамнезе необходимо рассмотреть возможность применения других видов противодиабетической терапии
Гипогликемия. При применении Трулисити™ со стимулятором секреции инсулина (например, сульфонилмочевиной) или инсулином, необходимо рассмотреть возможность снижения дозы сульфонилмочевины или инсулина для уменьшения риска гипогликемии.
Реакции гиперчувствительности. При развитии симптомов гиперчувствительности необходимо прекратить прием Трулисити™ и провести симптоматическое лечение.
Почечная недостаточность. Об острой почечной недостаточности и прогрессировании хронической почечной недостаточности, которые иногда могут требовать проведения гемодиализа сообщалось у пациентов, с известным фоновым заболеванием почек, получавших агонисты рецепторов GLP-1. Большинство сообщений имели место у пациентов, у которых наблюдались тошнота, рвота, диарея или дегидратация. Так как данные реакции могут ухудшить функцию почек, необходимо соблюдать осторожность при начале приема или увеличении дозы Трулисити™ у пациентов с почечной недостаточностью. В связи с этим, необходимо контролировать функцию почек у пациентов с почечной недостаточностью, сообщая о тяжелых нежелательных реакциях со стороны желудочно-кишечного тракта.
Макрососудистые реакции. Отсутствуют исследования, подтверждающие риск развития макроангиопатий при применении Трулисити™ или какого-либо другого противодиабетического препарата.
Беременность и период лактации.
Адекватные и хорошо контролируемые исследования Трулисити™ у беременных женщин отсутствуют. Риск врожденных пороков, невынашивания или других нежелательных реакций повышен при беременностях, осложненных гипергликемией, и может быть снижен при хорошем метаболическом контроле. Для пациентов с сахарным диабетом важно поддерживать хороший метаболический контроль перед зачатием и в течение беременности. Трулисити™ следует использовать во время беременности, только если потенциальная польза оправдывает возможный риск для плода.
У крыс и кроликов дулаглутид, который вводился в течение периода органогенеза, вызывал замедление роста плода и/или скелетные аномалии и недостаточное окостенение в сочетании с пониженной массой тела матери и сниженным потреблением пищи, имеющие отношение к фармакологии дулаглутида. У беременных крыс, получавших подкожные инъекции дулаглутида в дозах 0,49, 1,63 или 4,89 мг/кг в 6, 9, 12 и 15 день беременности (органогенез), сниженный вес плода, связанный со сниженным потреблением пищи и сниженной прибавкой массы тела вследствие фармакологии дулаглутида, наблюдался при концентрации ≥1,63 мг/кг, системном воздействии ≥14 максимальных рекомендованных доз для человека на основании AUC (площадь под фармакокинетической кривой). Аномальное окостенение и увеличение постимплантационных выкидышей также наблюдалось при концентрации 4,89 мг/кг, системном воздействии ≥44 максимальных рекомендованных доз для человека на основании AUC. При 4-кратной максимальной рекомендованной для человека дозе на основании AUC не наблюдалось никаких нежелательных реакций, связанных с пороками развития.
Данные о выделении дулаглутида с молоком матери отсутствуют. Необходимо прекратить грудное вскармливание в период лечения Трулисити™. Так как многие лекарственные препараты выделяются с молоком человека и из-за возможных клинических нежелательных реакций лекарственного препарата Трулисити™ у детей, находящихся на грудном вскармливании, необходимо принять решение прекратить грудное вскармливание или прекратить прием Трулисити™, принимая во внимание важность лекарственного препарата для матери.
Применение в пожилом возрасте.
В совокупности плацебо- и активно-контролируемых исследований. Нежелательные реакции 62 (18.6%) пациентов, получавших Трулисити™, были 65 лет и старше, а 65 (1.9%) пациентов, получавших Трулисити™, были 75 лет и старше. Общих различий в безопасности и эффективности между данными пациентами и пациентами более молодого возраста не выявлены, но нельзя исключать более высокую чувствительность у пациентов старшего возраста.
Имеется ограниченный клинический опыт применения лекарственного препарата у пациентов с печеночной недостаточностью. Следует с осторожностью использовать Трулисити™ у пациентов с печеночной недостаточностью различной степени тяжести.
В клинико-фармакологических исследованиях не наблюдалось клинически значимых изменений фармакокинетики дулаглутида у пациентов с печеночной недостаточностью различной степени тяжести.
В четырех рандомизированных клинических исследованиях II фазы и пяти рандомизированных клинических исследованиях III фазы на этапе включения в исследование у 50 (1.2%) пациентов, получавших Трулисити™, была почечная недостаточность легкой степени тяжести (рСКФ ≥ 60 но ≤ 90 мл/мин./1.73 м2), 171 (4.3%) пациентов, получавших Трулисити™, была почечная недостаточность средней степени тяжести (рСКФ ≥ 30 но ≤ 60 мл/мин./1.73 м2) и не было пациентов, получавших Трулисити™, была тяжелая почечная недостаточность (рСКФ ≥ 30 мл/мин./1.73 м2). Не наблюдалось общих различий в безопасности и эффективности относительно пациентов с нормальной почечной функцией, включая терминальную почечную недостаточность, таким образом, выводы ограничены вследствие небольшого количества случаев. В клинико-фармакологических исследованиях не наблюдалось клинически значимых изменений фармакокинетики дулаглутида у пациентов с печеночной недостаточностью различной степени тяжести. Имеется ограниченный клинический опыт применения лекарственного препарата у пациентов с тяжелой почечной недостаточностью или терминальной почечной недостаточностью. Необходимо с осторожностью использовать Трулисити™, если у данных пациентов наблюдаются нежелательные побочные эффекты со стороны желудочно-кишечного тракта, почечная функция должна тщательно контролироваться.
Парез желудка. Дулаглутид замедляет опорожнение желудка. Трулисити™ не изучался у пациентов с предшествующим парезом желудка.
Трулисити™ не рекомендуется в качестве терапии первой линии для пациентов с недостаточным контролем с помощью диеты и физических упражнений. Трулисити™ не исследовался у пациентов с панкреатитом в анамнезе. У пациентов с панкреатитом в анамнезе следует рассмотреть возможность проведения другого вида противодиабетической терапии. Трулисити™ не следует использовать у пациентов с сахарным диабетом I типа или для лечения диабетического кетоацидоза. Трулисити™ не является заменителем инсулина. Трулисити™ не изучался у пациентов с тяжелым заболеванием желудочно-кишечного тракта, включая парез желудка тяжелой степени. Совместное применение Трулисити™ и базального инсулина не изучалось.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Никаких исследований воздействия на способность управлять транспортными средствами и машин не были выполнены. При применении дулаглутида в сочетании с сульфонилмочевины или инсулином, пациентам рекомендуется соблюдать меры предосторожности, во избежание развития гипергликемии при управлении транспортными средствами и механизмами.
ПередозировкаСлучаи передозировки были зарегистрированы в клинических исследованиях. Эффекты, связанные с данными передозировками, были первичными явлениями со стороны желудочно-кишечного тракта легкой и средней степени (тошнота, рвота) и нетяжелая гипогликемия. В случае передозировки необходимо начать соответствующее симптоматическое лечение (включая частый мониторинг глюкозы крови).
Форма выпуска и упаковкаПо 0.5 мл препарата помещают в шприц-ручку. На шприц-ручку наклеивают этикетку самоклеящуюся. По 4 шприц-ручки вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в пачку из картона.
Условия храненияВ оригинальной упаковке, в защищенном от света месте при температуре от 2 до 8 °С. Не замораживать! Допускается хранение при температуре не выше 30 °С в течение не более 14 дней.
Хранить в недоступном для детей месте!
Срок храненияНе применять по истечении срока годности.
Условия отпуска из аптекНаименование и страна организации - производителя
Элай Лилли энд Компани, США
Наименование и страна владельца регистрационного удостоверения
Элай Лилли Восток С.А. Швейцария
Наименование и страна организации-упаковщика
Элай Лилли энд Компани, США
Адрес организации, принимающей претензии потребителей по качеству продукции (товара) на территории стран Центральной Азии и Монголии
Представительство компании «Элай Лилли Восток С.А.»
Республика Казахстан, 050059, г. Алматы, ул. Иванилова 21.
тел: 8 (727) 2 447 447
факс: 8 (727) 2 442 851